Pertemuan
VII
Polarisabilitas
Polarizabilitas/momen
dipol merupakan jumlah vektor dari momen ikatan dan juga momen pasangan
elektron bebas didalam suatu molekul dengan molekul bersifat polar jika
memiliki µ>0 atau µ≠0 dan sebaliknya molekul bersifat nonpolar jika memiliki
µ=0. Merupakan gaya yang bekerja antara molekul-molekul polar (senyawa kovalen
polar), yaitu molekul-molekul yang memiliki momen dipol.
·
Setiap
senyawa kovalen polar memiliki dipol, yaitu muatan yang terpolarisasi
(terkutubkan) menjadi muatan positif dan negatif.
·
Dipol-dipol
yang berbeda akan saling tarik-menarik, sedangkan yang berlawanan akan
tolak-menolak. Makin besar momen dipolnya, semakin kuat gayanya.
Gaya
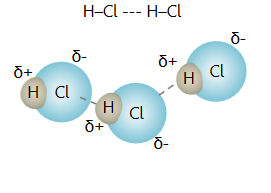
ini terjadi karena adanya gaya dipol antar molekul, contohnya pada HCl berikut
:
Kutub-kutub
pada molekul terbentang sehingga satu ujung molekul polar yang positif akan berinteraksi
ujung negatif molekul berikutnya.
Ø
Molekul
polar biasanya asimetrik dan memiliki atom-atom dengan elektronegativitas yang berbeda.
“Like dissolves like”
Ø
Molekul
polar akan terlarut dalam pelarut polar dan molekul non polar akan
terlarut dalam pelarut non polar
Jumlah elektron dalam suatu
molekul berbanding lurus dengan massa molekulnya oleh karena itu
kebolehpolaransuatu molekul semakin tinggi dengan bertambahnya massa
molekulnya. Kenaikan kebolehpolaran molekul menyebabkan semakin mudahnya
molekul tersebut membentuk dipol sesaat dan dipol induksian sehingga gaya
london yang yang terjadi in kuat.
Adanya gaya london antara
molekul-molekul nonpolar menyebabkan pada waktu peleburan dan pendidihan
diperlukan sejumlah enengi untuk memperbesar jarak antara molekul-molekul
nonpolar. Semakin kuat gaya london antar molekul-molekul, semakin besar pula
energi yang digunakan untuk terjadinya peleburan dan pendidihan. Hal ini
ditunjukkan dengan titik lebur dan titik didih zat seperti contoh pada tabel.
Kebolehpolaran molekul yang
berisomer tergantung pada bentuknya. Dalam hal ini semakin tinggi tingkat
simentri suatu molekul, maka awan elektronnya akan semakin sulit untuk
dipolarisasi sehingga Kebolehpolarannya semakin rendah, akibat dipol sesaat
molekul tersebut semakin sulit terbentuk. Molekul n-pentana dan neopentana
merupakan senyawa yang berisomer tetapi dengan bentuk awan elektron yang
berbeda. Molekul n-pentana yang berbentuk lurus awan elektronnya dapat
dianggap bentuk silinder, sedangkan neopentana yang berbentuk tetrahedral awan
elektronnya dapat dianggap berbentuk bola. Karena bola lebih simetri dari pada
silinder n-pentana lebih mudah dipopularisasi dari pada awan elektron
neopentana, kebolehpolaran n-pentana lebih tinggi dari pada kebolehpolaran
neopentana. Akibatnya pada molekul n-pentana lebih mudah terbentuk dipol
sesaat atau dipol induksian dibanding pada molekul neopentana. Mudahnya dipol
sesaat dan dipol induksian terbentuk memperbesar kekuatan gaya london yang
terjadi.
Sumber :